Какой препарат является прямым ингибитором ренина. Новые и перспективные лекарственные препараты, блокирующие ренин-ангиотензин-альдостероновую систему
Ответ на этот вопрос несложен:
Пункт первый: для того, чтобы осмысленно разобраться в этом вопросе, нужно закончить мединститут. После этого можно теоретически предположить, что препарат А у пациента Х с одним "букетом" болезней будет работать лучше, чем препарат Б у пациента У с другим "букетом", однако:
Пункт второй: у каждого пациента сила эффекта любого препарата и уровень побочных эффектов непредсказуемы и все теоретические рассуждения на эту тему бессмысленны.
Пункт третий: препараты внутри одного класса при условии соблюдения терапевтических доз обычно имеют примерно одинаковое действие, однако в некоторых случаях - смотри пункт второй.
Пункт четвертый: на вопрос "что лучше - арбуз или свиной хрящик?" разные люди ответят по-разному (На вкус и цвет товарищей нет). Так же разные врачи по-разному ответят на вопросы о препаратах.
Насколько хороши новейшие (новые, современные) препараты от гипертонии?
Публикую даты регистрации в России "новейших" препаратов от гипертонии:
Эдарби (Азилсартан) - февраль 2014г.
Расилез (Алискирен) - май 2008г.
Степень "новейшести" оценивайте сами.
К сожалению, все новые препараты от гипертонии (представители классов АРА (БРА) и ПИР) не являются более сильными, чем изобретенный более 30 лет назад эналаприл, доказательная база (количество исследований на пациентах) у новых препаратов меньше, а цена выше. Поэтому рекомендовать "новейшие препараты от гипертонии" только потому, что они новейшие, я не могу.
Неоднократно приходилось пациентов, которые пожелали начать лечение с "чего-нибудь поновее", возвращать к более старым препаратам из-за неэффективности новых.
Где дешево купить лекарство от гипертонии?
Есть простой ответ на этот вопрос: ищите сайт - аптечный поисковик в своем городе (области). Для этого набираете в Яндексе или в Google фразу "аптечная справочная" и название своего города.
Для Москвы работает очень хороший поисковик aptekamos.ru .
В поисковую строку вводите название лекарства, выбираете дозировку препарата и свое место жительства - и сайт выдает адреса, телефоны, цены и возможность доставки на дом.
Можно ли заменить препарат А препаратом В? Чем можно заменить препарат С?
Эти вопросы очень часто задается в адрес поисковых систем, поэтому я запустил специальный сайт аналоги-лекарств.рф , и заполнение его начал с кардиологических препаратов.
Краткая справочная страничка, содержащая только названия лекарств и их классы - на этом сайте. Заходите !
Если точная замена препарата отсутствует (либо препарат снят с производства), можно ПОД КОНТРОЛЕМ ВРАЧА попробовать один из его "одноклассников". Читайте раздел "Классы препаратов от гипертонии".
Чем отличается препарат А от препарата В?
Чтобы ответить на этот вопрос, для начала зайдите на страничку аналогов препаратов (сюда) и выясните (а лучше запишите), какие действующие вещества из каких классов содержат оба препарата. Часто ответ лежит на поверхности (например, в один из двух просто добавлено мочегонное).
Если же препараты принадлежат к разным классам, прочитайте описания этих классов.
А чтобы абсолютно точно и адекватно разобраться в сравнении каждой пары препаратов, нужно все-таки закончить мединститут.
Введение
Написание этой статьи было продиктовано двумя соображениями.
Первое - распространенность гипертонии (самая частая кардиологическая патология - отсюда масса вопросов по лечению).
Второе - факт наличия в Интернете инструкций к препаратам. Несмотря на огромное количество предупреждений о невозможности самоназначения препаратов, бурная исследовательская мысль пациента заставляет читать информацию о препаратах и делать свои, далеко не всегда верные, выводы. Остановить это процесс невозможно, поэтому я изложил свой взгляд на вопрос.
ДАННАЯ СТАТЬЯ ПРЕДНАЗНАЧЕНА ИСКЛЮЧИТЕЛЬНО ДЛЯ ОЗНАКОМЛЕНИЯ С КЛАССАМИ АНТИГИПЕРТЕНЗИВНЫХ ПРЕПАРАТОВ И НЕ МОЖЕТ СЛУЖИТЬ РУКОВОДСТВОМ К САМОСТОЯТЕЛЬНОМУ НАЗНАЧЕНИЮ ЛЕЧЕНИЯ!
НАЗНАЧЕНИЕ И КОРРЕКЦИЯ ЛЕЧЕНИЯ ГИПЕРТОНИИ ДОЛЖНЫ ПРОВОДИТЬСЯ ТОЛЬКО ПОД ОЧНЫМ КОНТРОЛЕМ ВРАЧА!!!
В Интернете размещена масса рекомендаций по ограничению потребления поваренной соли (хлорида натрия) при гипертонии. Исследования показали, что даже достаточно жесткое ограничение приема поваренной соли приводит к снижению цифр артериального давления не более чем на 4-6 единиц, поэтому лично я отношусь к таким рекомендациям достаточно скептически.
Да, в случае тяжелой гипертонии хороши все средства, при сочетании гипертонии с сердечной недостаточностью ограничение соли также совершенно необходимо, но при невысокой и нетяжелой гипертонии бывает жалко смотреть на пациентов, которые отравляют себе жизнь ограничением приема соли.
Думаю, для пациентов со "средней" гипертонией достаточной будет рекомендация "не есть соленые огурцы (или аналоги) трехлитровыми банками."
При неэффективности либо недостаточной эффективности нелекарственного лечения назначается фармакологическая терапия.
Какова стратегия подбора антигипертензивной терапии?
Когда пациент с гипертонией впервые обращается к врачу, ему проводится некоторый объем исследований, зависящий от оснащения клиники и финансовых возможностей пациента.
Достаточно полное обследование включает в себя:
- Лабораторные методы:
- Общий анализ крови.
- Общий анализ мочи для исключения почечного происхождения гипертензии.
- Глюкоза крови, гликозилированный гемоглобин с целью скрининга сахарного диабета.
- Креатинин, мочевина крови с целью оценки функции почек.
- Общий холестерин, холестерин липопротеидов высокой и низкой плотности, триглицериды с целью оценки степени атеросклеротического процесса.
- АСТ, АЛТ с целью оценки функции печени при возможной необходимости назначения холестеринснижающих препаратов (статинов).
- Т3 свободный, Т4 свободный и ТТГ с целью оценки функции щитовидной железы.
- Неплохо посмотреть мочевую кислоту - подагра и гипертония часто вместе.
- Аппаратные методы:
- СМАД (суточное мониторирование артериального давления) с целью оценки суточных колебаний.
- Эхокардиография (УЗИ сердца) с целью оценки толщины миокарда левого желудочка (есть гипертрофия или нет).
- Дуплексное сканирование сосудов шеи (обычно называется МАГ или БЦА) с целью оценки наличия и тяжести атеросклероза.
- Консультации специалистов:
- Окулиста (с целью оценки состояния сосудов глазного дна, которые часто поражаются при гипертонии).
- Эндокринолога-диетолога (в случае повышенного веса пациента и отклонениях в анализах на гормоны щитовидной железы).
- Самообследование:
- СКАД (СамоКонтроль Артериального Давления) - измерение и запись цифр давления и пульса на двух руках (или на той, где давление выше) утром и вечером в положении сидя после 5 минут спокойного сидения. Результаты записи СКАД после 1-2 недель предъявляются врачу.
Результаты, полученные при обследовании, могут повлиять на лечебную тактику врача.
Теперь об алгоритме подбора лекарственного лечения (фармакотерапии).
Адекватное лечение должно приводить к снижению давления до так называемых целевых значений (140/90 мм рт ст, при сахарном диабете - 130/80). Если цифры выше - лечение неправильное. НАЛИЧИЕ ГИПЕРТОНИЧЕСКИХ КРИЗОВ ТАКЖЕ ЯВЛЯЕТСЯ ДОКАЗАТЕЛЬСТВОМ НЕАДЕКВАТНОГО ЛЕЧЕНИЯ.
Лекарственное лечение гипертонии ДОЛЖНО ПРОДОЛЖАТЬСЯ ПОЖИЗНЕННО, поэтому решение о его начале должно быть жестко обоснованным.
При невысоких цифрах давления (150-160) грамотный врач обычно сначала назначает один препарат в небольшой дозе, пациент уходит на 1-2 недели для записи СКАД. Если на начальной терапии установились целевые уровни, пациент продолжает принимать лечение длительно и поводом для встреч с врачом является только повышение АД выше целевого, что требует корректировки лечения.
ВСЕ УТВЕРЖДЕНИЯ О ПРИВЫКАНИИ К ПРЕПАРАТАМ И НЕОБХОДИМОСТИ ИХ ЗАМЕНЫ ПРОСТО ИЗ-ЗА ДЛИТЕЛЬНОГО ВРЕМЕНИ ПРИЕМА ЯВЛЯЮТСЯ ВЫМЫСЛОМ. ПОДХОДЯЩИЕ ПРЕПАРАТЫ ПРИНИМАЮТ ГОДАМИ, И ЕДИНСТВЕННЫМИ ПОВОДАМИ ДЛЯ ЗАМЕНЫ ПРЕПАРАТА ЯВЛЯЮТСЯ ТОЛЬКО НЕПЕРЕНОСИМОСТЬ И НЕЭФФЕКТИВНОСТЬ.
Если давление у пациента на фоне назначенной терапии остается выше целевого - врач может увеличить дозы либо добавить второй и в тяжелых случаях - третий и даже четвертый препарат.
Оригинальные препараты или дженерики (генерики) - как сделать выбор?
Прежде чем перейти к рассказу о препаратах, коснусь очень важного вопроса, который ощутимо касается кошелька каждого пациента.
Создание новых лекарств требует очень больших денег - в настоящее время на разработку одного препарата тратится не менее МИЛЛИАРДА долларов. В связи с этим компания-разработчик по международному законодательству имеет так называемый срок патентной защиты (от 5 до 12 лет), в течение которого другие производители не имеют права выводить на рынок копии нового препарата. За этот срок компания-разработчик имеет шанс вернуть вложенные в разработку деньги и получить максимальную прибыль.
Если новый препарат оказался эффективным и востребованным, по окончании срока патентной защиты другие фармацевтические фирмы приобретают полное право выпускать копии, так называемые генерики (или дженерики). И правом этим они активно пользуются.
Соответственно, не копируют препараты, которые вызывают малый интерес у пациентов. Я предпочитаю не использовать "старые" оригинальные препараты, у которых нет копий. Как говорил Винни-Пух, это "жжж" неспроста.
Зачастую производители дженериков предлагают более широкий диапазон доз, чем производители оригинального препарата (например, Энап производства КRКА). Это дополнительно привлекает потенциальных потребителей (процедура разламывания таблеток мало кого радует).
Дженерики дешевле оригинальных препаратов, но, поскольку выпускают их компании с МЕНЬШИМИ финансовыми возможностями, производственные технологии дженериковых заводов вполне могут быть менее эффективными.
Тем не менее компании-производители дженериков весьма неплохо чувствуют себя на рынках, и чем беднее страна - тем больший процент дженериков в общем объеме фармацевтического рынка.
Статистические данные говорят о том, что в России доля дженерических препаратов на фармацевтическом рынке достигает до 95%. Данный показатель в других странах: Канада — более 60%, Италия — 60%, Англия — более 50%, Франция — около 50%, Германия и Япония — по 30%, США — менее 15%.
Поэтому перед пациентом в отношени джененриков стоят два вопроса:
- Что покупать - оригинальный препарат или дженерик?
- Если сделан выбор в пользу дженерика - какого производителя предпочесть?
- Если есть финансовая возможность покупать оригинальный препарат - лучше купить оригинал.
- Если есть выбор между несколькими дженериками, лучше купить препарат известного, "старого" и европейского производителя, чем неизвестного, нового и азиатского.
- Препараты ценой менее 50-100 рублей, как правило, работают крайне плохо.
И последняя рекомендация. При лечении тяжелых форм гипертонии, когда комбинируются 3-4 препарата, прием дешевых дженериков вообще невозможен, поскольку врач рассчитывает на работу препарата, который реально действия не оказывает. Врач может комбинировать и увеличивать дозы без эффекта, и порой просто замена некачественного дженерика на хороший препарат снимает все вопросы.
Рассказывая про препарат, я буду вначале указывать его международное название, потом оригинальное фирменное название, потом названия заслуживающих доверия дженериков. Отсутствие назания дженерика в списке говорит об отсутствии у меня опыта общения с ним либо о нежелании по той или иной причине рекомендовать его широкой публике.
Какие классы препаратов от гипертонии существуют?
Существуют 7 классов препаратов:
Ингибиторы ангиотензинпревращающего фермента (ИАПФ)
Это препараты, которые в свое время произвели революцию в лечении гипертонической болезни.
В 1975 году был синтезирован каптоприл (капотен), который и в настоящее время применяется для купирования кризов (применение его в постоянном лечении гипертонии нежелательно из-за короткого периода действия препарата).
В 1980 году компанией Мерк был синтезирован эналаприл (ренитек), который и сейчас остается одним из самых назначаемых препаратов в мире, несмотря на интенсивную работу фармацевтических фирм по созданию новых лекарств. В настоящее время аналоги эналаприла выпускают более 30 заводов, и это говорит о его хороших качествах (плохие препараты не копируют).
Остальные прапараты группы ничем существенным друг от друга не отличаются, поэтому немного расскажу про эналаприл и приведу названия других представителей класса.
К сожалению, достоверный срок действия эналаприла меньше 24 часов, поэтому лучше его принимать 2 раза в день - утром и вечером.
Суть действия первых трех групп препаратов - ИАПФ, АРА и ПИР - блокировка выработки одного из самых мощных сосудосуживающих веществ в огранизме - ангиотензина 2. Все препараты этих групп снижают систолическое и диастоличесоке давление, не влияя на частоту пульса.
Самый частый побочный эффект ингибиторов АПФ - появление сухого кашля через месяц и более после начала приема. Если кашель появляется, препарат нужно заменять. Обычно меняют на представителей более новой и дорогой группы БРА (АРА).
Полный эффект от применения ИАПФ достигается к концу первой - второй недели приема, поэтому все более ранние цифры АД не отражают степень эффекта препарата.
Все представители ингибиторов АПФ с ценами и формами выпуска .
Антагонисты (блокаторы) рецепторов ангиотензина (сартаны или АРА или БРА)
Данный класс препаратов создавался для пациентов, имевших кашель как побочное действие ингибиторов АПФ.
На данный момент ни одна из фирм, производящих БРА, не утверждает, что эффект этих препаратов сильнее, чем у ингибиторов АПФ. Это подтверждают и результаты больших исследований. Поэтому назначение БРА как первого препарата, без попыток назначить иАПФ, лично я расцениваю как признак положительной оценки врачом толщины кошелька пациента. Цены на месяц приема ни у одного из оригинальных сартанов пока не упали существенно ниже тысячи рублей.
Полного своего эффекта БРА достигают к концу второй - четвертой недели приема, поэтому оценка действия препарата возможна только по прошествии двух и более недель.
Представители класса:
- Лозартан (Козаар (50мг), Лозап (12,5мг, 50мг, 100 мг), Лориста (12,5мг, 25мг, 50мг, 100мг), Вазотенз (50мг, 100мг))
- Эпросартан (Теветен (600мг))
- Валсартан (Диован (40мг, 80мг, 160мг), Вальсакор, Валз (40мг, 80мг, 160мг), Нортиван (80мг), Валсафорс (80мг, 160мг))
- Ирбесартан (Апровель (150мг, 300мг))
- Кандесартан (Атаканд (80мг, 160мг, 320 мг))
- Телмисартан (Микардис (40мг, 80 мг))
- Олмесартан (Кардосал (10мг, 20мг, 40мг))
- Азилсартан (Эдарби (40мг, 80мг))
Прямые ингибиторы ренина (ПИР)
Данный класс пока состоит только из одного представителя, причем даже производитель признает, что его нельзя применять в качестве единственного средства для лечения гипертонической болезни, а только в комбинации с другими препаратами. В сочетании с высокой ценой (не менее полутора тысяч рублей на месяц приема) я не считаю этот препарат очень привлекательным для пациента.
- Алискирен (Расилез (150мг, 300мг))
За разработку этого класса препаратов создатели получили Нобелевскую премию - первый случай для "промышленных" ученых. Главными эффектами бэта-блокаторов являются урежение пульса и снижение давления. Поэтому применяются они главным образом у гипертоников с частым пульсом и при сочетании гипертонии со стенокардией. КРоме того, бэта-блокаторы имеют неплохой антиаритмический эффект, поэтому их назначение оправдано при сопутствующей экстрасистолии и тахиаритмиях.
Нежелательно применение бэта-блокаторов у молодых мужчин, так как все представители этого класса отрицательно влияют на потенцию (к счастью, не у всех пациентов).
В аннотациях ко всем ББ в противопоказаниях фигурируют бронхиальная астма и сахарный диабет, однако опыт показывает, что довольно часто пациенты с астмой и диабетом неплохо "уживаются" с бэта-блокаторами.
Старые представители класса (пропранолол (обзидан, анаприлин), атенолол) для лечения гипертонии непригодны в силу короткого срока действия.
Короткодействующие формы метопролола я не привожу здесь по той же причине.
Представители класса бэта-блокаторов:
- Метопролол (Беталок ЗОК (25мг, 50мг, 100мг), Эгилок ретард (100мг, 200мг), Вазокардин ретард (200мг), Метокард ретард (200мг))
- Бисопролол (Конкор (2,5мг, 5мг, 10мг), Коронал (5мг, 10мг), Биол (5мг, 10мг), Бисогамма (5мг, 10мг), Кординорм (5мг, 10мг), Нипертен (2,5мг; 5мг; 10мг), Бипрол (5мг, 10мг), Бидоп (5мг, 10мг), Арител (5мг, 10мг))
- Небиволол (Небилет (5мг), Бинелол (5мг))
- Бетаксолол (Локрен (20мг))
- Карведилол (Карветренд (6,25мг, 12,5мг, 25мг), Кориол (6,25мг, 12,5мг, 25мг), Таллитон (6,25мг, 12,5мг, 25мг), Дилатренд (6,25мг, 12,5мг, 25мг), Акридиол (12,5мг, 25мг))
Антагонисты кальция пульсурежающие (АКП)
По действию похожи на бэта-блокаторы (урежают пульс, снижают давление), только механизм другой. Официально разрешено применение этой группы при бронхиальной астме.
Привожу только "долгоиграющие" формы представителей группы.
- Верапамил (Изоптин СР (240мг), Верогалид ЕР (240мг))
- Дилтиазем (Алтиазем РР (180мг))
Антагонисты кальция дигидропиридиновые (АКД)
Эпоха АКД началась с прапарата, который знаком всем, однако современные рекомендации его прием, мягко говоря, не рекомендуют даже при гипертонических кризах.
Нужно прочно отказаться от приема этого препарата: нифедипин (адалат, кордафлекс, кордафен, кордипин, коринфар, нифекард, фенигидин).
Более современные дигидропиридиновые антагонисты кальция прочно заняли свое место в арсенале антигипертензивных средств. Они значительно меньше учащают пульс (в отличие от нифедипина), хорошо снижают давление, применяются один раз в сутки.
Есть данные, что длительный прием препаратов этой группы оказывает профилактическое действие в отношении болезни Альцгеймера.
Амлодипин по количеству выпускающих его заводов сравним с "королем" иАПФ эналаприлом. Повторюсь, плохие препараты не копируют, только очень дешевые копии покупать нельзя.
В начале приема препараты этой группы могут давать отечность голеней и кистей рук, однако обычно она проходит в течении недели. Если не проходит, препарат отменяют или заменяют на "хитрую" форму Эс Корди Кор, которая этим эффектом почти не обладает.
Дело в том, что "обычный" амлодипин большинства производителей содержит смесь "правых" и "левых" молекул (они отличаются друг от друга, как правая и левая рука - состоят из тех же элементов, но организованы по-разному). "Правая" разновидность молекулы порождает большинство побочных эффектов, а "левая" обеспечивает основное лечебное действие. Фирма-производитель Эс Корди Кор оставила в лекарстве только полезную "левую" молекулу, поэтому доза препарата в одной таблетке уменьшена вдвое, а побочных эффектов меньше.
Представители группы:
- Амлодипин (Норваск (5мг, 10мг), Нормодипин (5мг, 10мг), Тенокс (5мг, 10мг), Корди Кор (5мг, 10мг), Эс Корди Кор (2,5мг, 5мг), Кардилопин (5мг, 10мг), Калчек (5мг, 10мг), Амлотоп (5мг, 10мг), Омелар кардио (5мг, 10мг), Амловас (5мг))
- Фелодипин (Плендил (2,5мг, 5мг, 10мг), Фелодип (2,5мг, 5мг, 10мг))
- Нимодипин (Нимотоп (30мг))
- Лацидипин (Лаципил (2мг, 4мг), Сакур (2мг, 4мг))
- Лерканидипин (Леркамен (20мг))
Препараты центрального действия (точка приложения - головной мозг)
Началась история этой группы с клофелина, который "царствовал" до наступления эпохи ингибиторов АПФ. Клофелин сильно снижал давление (в случае передозировок - до комы), чем впоследствии активно воспользовалась криминальная часть населения страны (клофелиновые кражи). Клофелин также вызывал ужасающую сухость во рту, однако с этм приходилось мириться, так как другие препараты в то время были слабее. К счастью, славная история клофелина заканчивается, и купить его можно только по рецепту в очень небольшом числе аптек.
Более поздние препараты этой группы лишены побочного действия клофелина, но и "мощность" из существенно ниже.
Они обычно применяются в составе комплексной терапии у легковозбудимых пациентов и вечером при ночном характере кризов.
Допегит также применяется для лечения гипертонии у беременных женщин, так как большинство классов препаратов (ингибиторы АПФ, сартаны, бэта-блокаторы) обладают отрицательным действием на плод и применяться во время беременности не могут.
- Моксонидин (Физиотенз (0,2мг, 0,4мг), Моксонитекс (0,4мг), Моксогамма (0,2мг, 0,3мг, 0,4мг))
- Рилменидин (Альбарел (1мг)
- Метилдопа (Допегит (250 мг)
Мочегонные (диуретики)
В середине 20 века мочегонные широко применялись при лечении гипертонии, однако время выявило их недостатки (любые мочегонные со временем "вымывают" полезные вещества из организма, доказанно вызывают появление новых случаев сахарного диабета, атеросклероза, подагры).
Поэтому в современной литературе осталось только 2 показания к применению диуретиков:
- Лечение гипертонии у пожилых пациентов (старше 70 лет).
- В качестве третьего-четвертого препарата при недостаточном эффекте двух-трех уже назначенных.
При лечении гипертонии обычно применяют только два препарата, причем чаще всего в составе "заводских" (фиксированных) комбинированных таблеток.
Назначение быстродействующих мочегонных (фуросемид, торасемид (диувер)) крайне нежелательно. Верошпирон используется для лечения тяжелых случаев гипертонии и только под жестким очным контролем врача.
- Гидрохлоротиазид (Гипотиазид (25мг, 100мг)) - очень широко применяется в составе комбинированных препаратов
- Индапамид (Калийсберегающий) - (Арифон ретард (1,5мг), Равел СР (1,5мг), Индапамид МВ (1,5мг), Индап (2,5мг), Ионик ретард (1,5мг), Акрипамид ретард (1,5мг))
Для цитирования:
Леонова М.В. Новые и перспективные лекарственные препараты, блокирующие ренин-ангиотензин-альдостероновую систему // РМЖ. Медицинское обозрение. 2013. №17. С. 886
Роль ренин-ангиотензин-альдостероновой системы (РААС) в развитии артериальной гипертонии (АГ) и других сердечно-сосудистых заболеваний в настоящее время считается главенствующей. В кардиоваскулярном континууме АГ находится среди факторов риска, а главным патофизиологическим механизмом поражения сердечно-сосудистой системы является ангиотензин II (АТII). АТII является ключевым компонентом РААС - эффектором, который реализует вазоконстрикцию, задержку натрия, активацию симпатической нервной системы, клеточную пролиферацию и гипертрофию, развитие оксидативного стресса и процессов воспаления сосудистой стенки.
В настоящее время уже получили развитие и широкое клиническое применение два класса препаратов, блокирующих РААС, - ингибиторы АПФ и блокаторы рецепторов АТII. Фармакологические и клинические эффекты этих классов имеют отличия. АПФ является пептидазой из группы цинк-металлопротеиназ, которая метаболизирует АТI, АТ1-7, брадикинин, субстанцию Р и многие другие пептиды . Механизм действия ингибиторов АПФ главным образом связан с предотвращением образования АТII, что способствует вазодилатации, натрийурезу и устраняет провоспалительный, пролиферативный и другие эффекты АТII. Кроме того, ингибиторы АПФ препятствуют деградации брадикинина и повышают его уровень. Брадикинин - мощный вазодилататор, он потенцирует натрийурез, а главное - обладает кардиопротективным (предотвращает гипертрофию, уменьшает ишемическое повреждение миокарда, улучшает коронарное кровоснабжение) и вазопротективным действием, улучшая эндотелиальную функцию. Вместе с тем, высокий уровень брадикинина - причина развития ангионевротического отека, что является одним из серьезных недостатков ингибиторов АПФ, которые значительно повышают уровень кининов.
Ингибиторам АПФ не всегда удается полностью блокировать образование АТII в тканях. В настоящее время установлено, что в его превращении в тканях могут участвовать и другие ферменты, не связанные с АПФ, прежде всего эндопептидазы, на которые действие ингибиторов АПФ не распространяется. В результате ингибиторы АПФ не могут полностью устранить эффекты АТII, что может быть причиной их недостаточной эффективности.
Решению этой проблемы способствовало открытие рецепторов АТII и первого класса препаратов, селективно блокирующих АТ1-рецепторы. Через АТ1-рецепторы реализуются неблагоприятные эффекты АТII: вазоконстрикция, секреция альдостерона, вазопрессина, норадреналина, задержка жидкости, пролиферация гладкомышечных клеток и кардиомиоцитов, активация САС, а также механизм отрицательной «обратной связи» - образование ренина. АТ2-рецепторы выполняют «полезные» функции, такие как вазодилатация, процессы репарации и регенерации, антипролиферативное действие, дифференцировка и развитие эмбриональных тканей. Клинические эффекты блокаторов рецепторов АТII опосредованы через устранение «вредных» эффектов АТII на уровне АТ1-рецепторов, что обеспечивает более полное блокирование неблагоприятных эффектов АТII и усиление влияния АТII на АТ2-рецепторы, что дополняет вазодилатирующий и антипролиферативный эффекты. Блокаторы рецепторов АТII обладают специфичным действием на РААС, не вмешиваясь в кининовую систему. Отсутствие влияния на активность кининовой системы, с одной стороны, уменьшает выраженность нежелательных эффектов (кашель, ангионевротический отек), но, с другой, лишает блокаторы рецепторов АТII важного антиишемического и вазопротективного действия, что отличает их от ингибиторов АПФ. По этой причине показания к применению блокаторов рецепторов АТII в большинстве повторяют показания к назначению ингибиторов АПФ, делают их альтернативными препаратами.
Несмотря на внедрение блокаторов РААС в широкую практику лечения АГ, проблемы улучшения исходов и прогноза остаются. К ним относятся: возможность улучшения контроля АД в популяции, эффективность лечения резистентной АГ, возможности дальнейшего снижения риска сердечно-сосудистых заболеваний.
Поиск новых путей воздействия на РААС активно продолжается; изучаются другие тесно взаимодействующие системы и создаются препараты с множественным механизмом действия, такие как ингибиторы АПФ и нейтральной эндопептидазы (НЭП), ингибиторы эндотелин-превращающего фермента (ЭПФ) и НЭП, ингибиторы АПФ/НЭП/ЭПФ .
Ингибиторы вазопептидаз
К вазопептидазам кроме известного АПФ относятся еще 2 других цинк-металлопротеиназы - неприлизин (нейтральная эндопептидаза, НЭП) и эндотелин-превращающий фермент, которые также могут быть мишенями для фармакологического воздействия.
Неприлизин - фермент, вырабатываемый эндотелием сосудов и участвующий в деградации натрийуретического пептида, а также брадикинина.
Система натрийуретического пептида представлена тремя разными изоформами: предсердным натрий-уретическим пептидом (А-тип), мозговым натрийуретическим пептидом (В-тип), которые синтезируются в предсердии и миокарде, и эндотелиальным С-пептидом, которые по своим биологическим функциям являются эндогенными ингибиторами РААС и эндотелина-1 (табл. 1) . Кардиоваскулярные и ренальные эффекты натрийуретического пептида заключаются в снижении АД через влияние на сосудистый тонус и водноэлектролитный баланс, а также в антипролиферативном и антифибротическом действии на органы-мишени. По самым последним данным, система натрийуретического пептида участвует в метаболической регуляции: окислении липидов, образовании и дифференцировке адипоцитов, активации адипонектина, секреции инсулина и толерантности к углеводам, что может обеспечивать защиту от развития метаболического синдрома .
К настоящему времени стало известно, что развитие сердечно-сосудистых заболеваний ассоциируется с дизрегуляцией системы натрийуретического пептида. Так, при АГ наблюдается дефицит натрийуретического пептида, приводящий к солечувствительности и нарушению натрийуреза; при хронической сердечной недостаточности (ХСН) на фоне дефицита наблюдается аномалия функционирования гормонов системы натрийуретического пептида .
Поэтому для потенцирования системы натрийуретического пептида с целью достижения дополнительного гипотензивного и протективных кардиоренальных эффектов возможно применение ингибиторов НЭП. Ингибирование неприлизина приводит к потенцированию натрийуретического, диуретического и вазодилатирующего эффектов эндогенного натрийуретического пептида и в результате - к снижению АД. Однако НЭП участвует в деградации и других вазоактивных пептидов, в частности АТI, АТII и эндотелина-1. Поэтому баланс эффектов воздействия на сосудистый тонус ингибиторов НЭП вариабельный и зависит от преобладания констрикторных и дилатирующих влияний. При длительном применении антигипертензивное действие ингибиторов неприлизина выражено слабо вследствие компенсаторной активации образования АТII и эндотелина-1 .
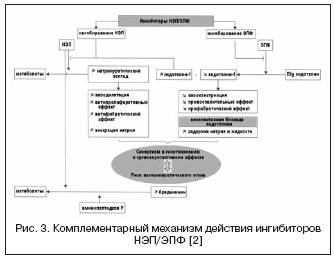
В этой связи сочетание эффектов ингибиторов АПФ и ингибиторов НЭП может существенно потенцировать гемодинамические и антипролиферативные эффекты в результате комплементарного механизма действия, что привело к созданию препаратов с двойным механизмом действия, объединенных названием - ингибиторы вазопептидаз (табл. 2, рис. 1) .
Известные ингибиторы вазопептидаз характеризуются разной степенью селективности к НЭП/АПФ: омапатрилат - 8,9:0,5; фазидоприлат - 5,1:9,8; сампатрилат - 8,0:1,2 . В результате ингибиторы вазопептидаз получили гораздо большие возможности в достижении гипотензивного эффекта вне зависимости от активности РААС и уровня задержки натрия и в органопротекции (регресс гипертрофии, альбуминурии, жесткости сосудов). Наиболее изученным в клинических исследованиях был омапатрилат, который показал более высокую гипотензивную эффективность в сравнении с ингибиторами АПФ, а у пациентов с ХСН приводил к увеличению фракции выброса и улучшению клинических исходов (исследования IMPRESS, OVERTURE), но без преимуществ перед ингибиторами АПФ .
Однако в крупных клинических исследованиях с применением омапатрилата была установлена более высокая частота развития ангионевротического отека в сравнении с ингибиторами АПФ. Известно, что частота развития ангионевротического отека при использовании ингибиторов АПФ составляет от 0,1 до 0,5% в популяции, из них 20% случаев являются жизнеугрожающими, что связано с многократным повышением концентраций брадикинина и его метаболитов . Результаты крупного многоцентрового исследования OCTAVE (n=25 302), которое было специально спланировано для изучения частоты развития ангионевротического отека, показало, что частота развития этого побочного эффекта на фоне лечения омапатрилатом превышает таковую в группе эналаприла - 2,17% против 0,68% (относительный риск 3,4) . Это объяснялось усилением влияния на уровень кининов при синергичном ингибировании АПФ и НЭП, связанным с ингибированием аминопептидазы Р, участвующей в деградации брадикинина .
Новый двойной ингибитор вазопептидаз, блокирующий АПФ/НЭП, - илепатрил, который имеет более высокую аффинность к АПФ в сравнении с НЭП . При изучении фармакодинамических эффектов илепатрила по влиянию на активность РААС и натрийуретического пептида у здоровых добровольцев было установлено, что препарат дозозависимо (в дозах 5 и 25 мг) и значимо (более 88%) подавляет АПФ в плазме крови продолжительностью более 48 ч вне зависимости от солечувствительности. Одновременно препарат значимо повышал активность ренина плазмы в течение 48 ч и уменьшал уровень альдостерона . Эти результаты показали выраженное и более продолжительное подавление РААС в отличие от ингибитора АПФ рамиприла в дозе 10 мг, что объяснялось более значимым тканевым действием илепатрила на АПФ и большей аффинностью к АПФ, и сопоставимую степень блокады РААС в сравнении с комбинацией 150 мг ирбесартана + 10 мг рамиприла. В отличие от действия на РААС, эффект илепатрила на натрийуретический пептид проявлялся кратковременным увеличением уровня его экскреции в период 4-8 ч после приема дозы 25 мг, что свидетельствует о меньшей и слабой аффинности к НЭП и отличает его от омапатрилата. Причем по уровню экскреции электролитов дополнительного натрийуретического действия в сравнении с рамиприлом или ирбесартаном у препарата нет, как впрочем, и у других ингибиторов вазопептидаз. Максимальное гипотензивное действие развивается через 6-12 ч после приема препарата, и снижение среднего АД составляет 5±5 и 10±4 мм рт.ст. при низкой и высокой солечувствительности соответственно . По фармакокинетическим характеристикам илепатрил представляет собой пролекарство с активным метаболитом, который быстро образуется с достижением максимальной концентрации через 1-1,5 ч и медленно элиминирует. В настоящее время проводятся клинические исследования III фазы.
Альтернативный путь к двойному подавлению РААС и НЭП представлен сочетанием блокады рецепторов АТII и НЭП (рис. 2) . Блокаторы рецепторов АТII не влияют на метаболизм кининов в отличие от ингибиторов АПФ, поэтому потенциально имеют меньший риск развития ангионевротических осложнений. В настоящее время проходит фазу III клинических исследований первый препарат - блокатор рецепторов АТII с эффектом ингибирования НЭП в соотношении 1:1 - LCZ696. Объединенная молекула препарата содержит валсартан и ингибитор НЭП (AHU377) в форме пролекарства . В крупном исследовании у больных с АГ (n=1328) препарат LCZ696 в дозах 200-400 мг показал преимущество в гипотензивном эффекте перед валсартаном в дозах 160-320 мг в виде дополнительного снижения АД на 5/3 и 6/3 мм рт.ст. . Гипотензивный эффект LCZ696 сопровождался более выраженным снижением пульсового АД: на 2,25 и 3,32 мм рт.ст. соответственно в дозах 200 и 400 мг, что в настоящее время рассматривается как положительный прогностический фактор по влиянию на жесткость сосудистой стенки и сердечно-сосудистые исходы. При этом изучение нейрогуморальных биомаркеров на фоне лечения LCZ696 показало увеличение уровня натрийуретического пептида при сопоставимой степени увеличения уровня ренина и альдостерона в сравнении с валсартаном. Переносимость у больных с АГ была хорошей, и случаев ангионевротического отека не было отмечено. В настоящее время завершено исследование PARAMOUMT у 685 пациентов с ХСН и ненарушенной ФВ . Результаты исследования показали, что LCZ696 быстрее и выраженнее снижает уровень NT-proBNP (первичная конечная точка - маркер повышения активности натрий-уретического пептида и неблагоприятного прогноза при ХСН) в сравнении с валсартаном, а также уменьшает размеры левого предсердия, что свидетельствует о регрессе его ремоделирования . Исследование у пациентов с ХСН и сниженной ФВ продолжается в настоящее время (исследование PARADIGM-HF).
Ингибиторы системы эндотелина
Система эндотелина играет важную роль в регуляции сосудистого тонуса и регионального кровотока. Среди трех известных изоформ эндотелин-1 является наиболее активным. Кроме известных вазоконстрикторных эффектов эндотелин стимулирует пролиферацию и синтез межклеточного матрикса, а также вследствие прямого воздействия на тонус почечных сосудов участвует в регуляции водно-электролитного гомеостаза. Эффекты эндотелина реализуются через взаимодействие со специфическими рецепторами А-типа и В-типа, функции которых взаимопротивоположны: через А-тип рецепторов происходит вазоконстрикция, а через В-тип - вазодилатация . В последние годы установлено, что рецепторы В-типа играют большую роль в клиренсе эндотелина-1, т.е. при блокаде этих рецепторов нарушается рецепторзависимый клиренс эндотелина-1 и увеличивается его концентрация . Кроме того, рецепторы В-типа участвуют в регуляции почечных эффектов эндотелина-1 и поддержании водно-электролитного гомеостаза, что имеет важное значение.
В настоящее время роль эндотелина доказана в развитии ряда заболеваний, в т.ч. АГ, ХСН, легочной гипертензии, хронических заболеваний почек; показана тесная связь между уровнем эндотелина и метаболическим синдромом, дисфункцией эндотелия и атерогенезом. С 1990-х гг. ведется поиск антагонистов рецепторов эндотелина, пригодных для клинического использования; уже известно 10 препаратов («сентаны») с разной степенью селективности к А/B-типу рецепторов . Первый неселективный антагонист рецепторов эндотелина - бозентан - в клиническом исследовании у больных с АГ показал гипотензивную эффективность, сопоставимую с таковой ингибитора АПФ эналаприла . Дальнейшие исследования эффективности применения антагонистов эндотелина при АГ показали их клиническую значимость в лечении резистентной АГ и при высоком сердечно-сосудистом риске. Эти данные были получены в двух крупных клинических исследованиях DORADO (n=379) и DORADO-АС (n=849), в которых пациентам с резистентной АГ добавлялся дарусентан к тройной комбинированной терапии . В исследовании DORADO у пациентов резистентная АГ сочеталась с хронической болезнью почек и протеинурией, в результате добавления дарусентана наблюдалось не только значительное снижение АД, но и уменьшение экскреции белка. Антипротеинурический эффект антагонистов рецепторов эндотелина был в последующем подтвержден в исследовании у пациентов с диабетической нефропатией при использовании авосентана . Однако в исследовании DORADO-АС преимуществ в дополнительном снижении АД перед препаратами сравнения и плацебо не было выявлено, что послужило поводом к прекращению дальнейших исследований. Кроме того, в 4 крупных исследованиях антагонистов эндотелина (бозентана, дарусентана, энрасентана) у пациентов с ХСН были получены противоречивые результаты, что объяснялось увеличением концентрации эндотелина-1 . Дальнейшее изучение антагонистов рецепторов эндотелина было приостановлено ввиду нежелательных эффектов, связанных с задержкой жидкости (периферические отеки, перегрузка объемом). Развитие этих эффектов связывают с воздействием антагонистов эндотелина на В-тип рецепторов, что изменило поиск препаратов, влияющих на систему эндотелина через другие пути; а антагонисты рецепторов эндотелина в настоящее время имеют только одно показание - лечение легочной гипертензии.
С учетом высокой значимости системы эндотелина в регуляции сосудистого тонуса ведется поиск другого механизма воздействия через вазопептидазу - ЭПФ, участвующий в образовании активного эндотелина-1 (рис. 3) . Блокирование ЭПФ и сочетание с ингибированием НЭП позволяют эффективно подавлять образование эндотелина-1 и потенцировать эффекты натрий-уретического пептида. Преимущества двойного механизма действия заключаются, с одной стороны, в предупреждении недостатков ингибиторов НЭП, связанных с возможной вазоконстрикцией, опосредованной активацией эндотелина, с другой, натрийуретическая активность ингибиторов НЭП позволяет компенсировать задержку жидкости, связанную с неселективной блокадой эндотелиновых рецепторов. Даглутрил является двойным ингибитором НЭП и ЭПФ, который находится во II фазе клинических исследований . В исследованиях показаны выраженные кардиопротективные эффекты препарата благодаря уменьшению ремоделирования сердца и сосудов, регрессу гипертрофии и фиброза.
Прямые ингибиторы ренина
Известно, что ингибиторы АПФ и блокаторы рецепторов АТII по механизму обратной связи повышают активность ренина, что является причиной ускользания эффективности блокаторов РААС. Ренин представляет собой самый первый этап каскада РААС; он вырабатывается юкстагломерулярными клетками почек. Ренин через ангиотензиноген способствует образованию АТII, вазоконстрикции и секреции альдостерона, а также регулирует механизмы обратной связи. Поэтому ингибирование ренина позволяет достичь более полной блокады системы РААС. Поиск ингибиторов ренина ведется с 1970-х гг.; долгое время не удавалось получить пер-оральную форму ингибиторов ренина ввиду их низкой биодоступности в ЖКТ (менее 2%). Первый прямой ингибитор ренина, пригодный для перорального применения, - алискирен - был зарегистрирован в 2007 г. Алискирен имеет низкую биодоступность (2,6%), большой период полувыведения (24-40 ч), внепочечный путь элиминации . Фармакодинамика алискирена связана с 80% уменьшением уровня АТII. В клинических исследованиях у пациентов с АГ алискирен в дозах 150-300 мг/сут приводил к снижению САД на 8,7-13 и 14,1-15,8 мм рт.ст. соответственно и ДАД - на 7,8-10,3 и 10,3-12,3 мм рт.ст. . Гипотензивный эффект алискирена наблюдался в разных подгруппах пациентов, включая больных с метаболическим синдромом, ожирением; по выраженности он был сопоставим с эффектом ингибиторов АПФ, блокаторов рецепторов АТII, а также отмечен аддитивный эффект в комбинации с валсартаном, гидрохлоротиазидом и амлодипином. В ряде клинических исследований были показаны органопротективные эффекты препарата: антипротеинурический эффект у пациентов с диабетической нефропатией (исследование AVOID, n=599) , регресс гипертрофии левого желудочка у пациентов с АГ (исследование ALLAY, n=465) . Так, в исследовании AVOID после 3-месячного лечения лозартаном в дозе 100 мг/сут и достижения целевого уровня АД (<130/80 мм рт.ст.) при компенсированном уровне гликемии (гликированный гемоглобин 8%) больных рандомизировали к приему алискирена в дозах 150-300 мг/сут или плацебо. Отмечено достоверное снижение индекса альбумин/креатинин в моче (первичная конечная точка) на 11% через 3 мес. и на 20% - через 6 мес. в сравнении с группой плацебо. В ночное время экскреция альбумина на фоне приема алискирена снизилась на 18%, а доля пациентов со снижением экскреции альбумина на 50% и более была вдвое большей (24,7% пациентов в группе алискирена против 12,5% в группе плацебо) . Причем нефропротективный эффект алискирена не был связан со снижением АД. Одним из объяснений выявленного нефропротективного эффекта у алискирена авторы считают полученные ранее в экспериментальных исследованиях на моделях диабета данные о способности препарата снижать количество рениновых и прорениновых рецепторов в почках, а также уменьшать профибротические процессы и апоптоз подоцитов, что обеспечивает более выраженный эффект в сравнении с эффектом ингибиторов АПФ . В исследовании ALLAY у пациентов с АГ и увеличением толщины миокарда ЛЖ (более 1,3 см по данным ЭхоКГ) применение алискирена ассоциировалось с одинаковой степенью регресса ИММЛЖ в сравнении с лозартаном и комбинацией алискирена с лозартаном: −5,7±10,6 , −5,4±10,8, −7,9±9,6 г/м2 соответственно. У части пациентов (n=136) проводилось изучение динамики нейрогормонов РААС, и было выявлено достоверное и значительное снижение уровня альдостерона и активности ренина плазмы на фоне применения алискирена или комбинации алискирена с лозартаном, тогда как на фоне применения монотерапии лозартаном эффект влияния на альдостерон отсутствовал, а на активность ренина - был противоположным, что объясняет значимость подавления альдостерона в достижении регресса ГЛЖ.
Кроме того, проводится серия клинических исследований алискирена при лечении других сердечно-сосудистых заболеваний с оценкой влияния на прогноз больных: исследования ALOFT (n=320), ASTRONAUT (n=1639), ATMOSPHERE (n=7000) у пациентов с ХСН, исследование ALTITUDE у пациентов с сахарным диабетом и высоким сердечно-сосудистым риском, исследование ASPIRE у пациентов с постинфарктным ремоделированием.
Заключение
Для решения проблем предупреждения сердечно-сосудистых заболеваний продолжается создание новых лекарственных препаратов со сложным множественным механизмом действия, позволяющих обеспечивать более полную блокаду РААС через каскад механизмов гемодинамической и нейрогуморальной регуляции. Потенциальные эффекты таких препаратов позволяют не только обеспечивать дополнительный гипотензивный эффект, но и достигать контроля уровня АД у пациентов высокого риска, включая резистентную форму АГ. Лекарственные препараты с множественным механизмом действия демонстрируют преимущества в более выраженном органопротективном действии, что позволит предупреждать дальнейшее поражение сердечно-сосудистой системы. Изучение преимуществ новых препаратов, блокирующих РААС, требует дальнейших исследований и оценки их влияния на прогноз больных с АГ и другими сердечно-сосудистыми заболеваниями.



Литература
1. Campbell D.J. Vasopeptidase inhibition: a doubleedged sword? // Hypertension. 2003. Vol. 41. P. 383-389.
2. Laurent S., Schlaich M., Esler M. New drugs, procedures, and devices for hypertension // Lancet. 2012. Vol. 380. P. 591-600.
3. Corti R., Burnett J.C., Rouleau J.L. et al. Vasopeptidase inhibitors: a new therapeutic concept in cardiovascular disease? // Circulation. 2001. Vol. 104. P. 1856-1862.
4. Mangiafico S., Costello-Boerrigter L.C., Andersen I.A. et al. Neutral endopeptidase inhibition and the natriuretic peptide system: an evolving strategy in cardiovascular therapeutics // Eur. Heart J. 2012, doi:10.1093/eurheartj/ehs262.
5. Rouleau J.L., Pfeffer M.A., Stewart D.J. et al. Comparison of vasopeptidase inhibitor, omapatrilat, and lisinopril on exercise tolerance and morbidity in patients with heart failure: IMPRESS randomised trial // Lancet. 2000. Vol. 356. P. 615-620.
6. Packer M., Califf R.M., Konstam M.A. et al. Comparison of omapatrilat and enalapril in patients with chronic heart failure: The Omapatrilat Versus Enalapril Randomized Trial of Utility in Reducing Events (OVERTURE) // Circulation. 2002. Vol. 106. P. 920-926.
7. Warner K.K., Visconti J.A., Tschampel M.M. Angiotensin II receptor blockers in patients with ACE inhibitor-induced angioedema // Ann. Pharmacother. 2000. Vol. 34. P. 526-528.
8. Kostis J.B., Packer M., Black H.R. et al. Omapatrilat and enalapril in patients with hypertension:the Omapatrilat Cardiovascular Treatment vs Enalapril (OCTAVE) trial // Am. J. Hypertens. 2004. Vol. 17. P. 103-111.
9. Azizi M., Bissery A., Peyrard S. et al. Pharmacokinetics and pharmacodynamics of the vasopeptidase inhibitor AVE7688 in humans // Clin. Pharmacol. Ther. 2006. Vol. 79. P. 49-61.
10. Gu J., Noe A., Chandra P. et al. Pharmacokinetics and pharmacodynamics of LCZ696, a novel dualacting angiotensin receptorneprilysin inhibitor (ARNi) // J. Clin. Pharmacol. 2010. Vol. 50. P. 401-414.
11. Ruilope L.M., Dukat A., Buhm M. et al. Bloodpressure reduction with LCZ696, a novel dualacting inhibitor of the angiotensin II receptor and neprilysin: a randomised, double-blind, placebo-controlled, active comparator study // Lancet. 2010. Vol. 375. P. 1255-1266.
12. Solomon S.D., Zile M., Pieske B. et al. The angiotensin receptor neprilysin inhibitor LCZ696 in heart failure with preserved ejection fraction: a phase 2 double-blind randomised controlled trial // Lancet. 2012. Vol. 380(9851). P. 1387-1395.
13. Levin E.R. Endothelins // N. Engl. J. Med. 1995. Vol. 333. P. 356-363.
14. Dhaun N., Goddard J., Kohan D.E. et al. Role of endothelin-1 in clinical hypertension: 20 years on // Hypertension. 2008. Vol. 52. P. 452-459.
15. Burnier M., Forni V. Endothelin receptor antagonists: a place in the management of essential hypertension? // Nephrol. Dial. Transplant. 2011. 0: 1-4. doi: 10.1093/ndt/gfr704.
16. Krum H., Viskoper R.J., Lacourciere Y. et al. The effect of an endothelin-receptor antagonist, bosentan, on blood pressure in patients with essential hypertension. Bosentan Hypertension Investigators // N. Engl. J. Med. 1998. Vol. 338. P. 784-790.
17. Weber M.A., Black H., Bakris G. et al. A selective endothelin-receptor antagonist to reduce blood pressure in patients with treatment-resistant hypertension: a randomised, double-blind, placebo-controlled trial // Lancet. 2009. Vol. 374. P. 1423-1431.
18. Bakris G.L., Lindholm L.H., Black H.R. et al. Divergent results using clinic and ambulatory blood pressures: report of a darusentan-resistant hypertension trial // Hypertension. 2010. Vol. 56. P. 824-830.
19. Mann J.F., Green D., Jamerson K. et al. Avosentan for overt diabetic nephropathy // J. Am. Soc. Nephrol. 2010. Vol. 21. P. 527-535.
20. Kalk P., Sharkovska Y., Kashina E. et al. Endothelinconverting enzyme/neutral endopeptidase inhibitor SLV338 prevents hypertensive cardiac remodeling in a blood pressure-independent manner // Hypertension. 2011. Vol. 57. P. 755-763.
21. Nussberger J., Wuerzner G., Jensen C. et al. Angiotensin II suppression in humans by theorally active renin inhibitor Aliskiren (SPP100): comparison with enalapril // Hypertension. 2002. Vol. 39(1). P. E1-8.
22. Alreja G., Joseph J. Renin and cardiovascular disease: Wornout path, or new direction? // World J. Cardiol. 2011. Vol. 3(3). P. 72-83.
23. Ingelfinger J.R. Aliskiren and dual therapy in type 2 diabetes mellitus // N. Engl. J. Med. 2008. Vol. 358(23). P. 2503-2505.
24. Pouleur A.С., Uno H., Prescott M.F., Desai A. (for the ALLAY Investigators). Suppression of aldosterone mediates regression of left ventricular hypertrophy in patients with hypertension // J. Renin-Angiotensin-Aldosterone System. 2011. Vol. 12. P. 483-490.
25. Kelly D.J., Zhang Y., Moe G. et al. Aliskiren, a novel renin inhibitor, is renoprotective in a model of advanced diabetic nephropathy in rats // Diabetol. 2007. Vol. 50. P. 2398-2404.
- КЛЮЧЕВЫЕ СЛОВА: ингибитор, синдром, метаболизм, алискирен, диабет, атеросклероз, ожирение, стенокардия, Расилез
Распространенность абдоминального ожирения и ассоциированного с ним метаболического синдрома настолько высока, что к настоящему времени это состояние признано пандемией ХХI века. Согласно данным ВОЗ, ожирение имеется у около 30% населения планеты. Кроме того, метаболический синдром (МС) имеет тесную взаимосвязь с предикторами сердечно-сосудистых заболеваний и предшествует развитию как атеросклероза, так и сахарного диабета (СД) типа 2 – заболеваний, которые в настоящее время являются основными причинами повышенной смертности населения.



Артериальная гипертония (АГ) является одним из проявлений совокупности метаболических отклонений, которые включают абдоминальное ожирение, характерную дислипидемию – низкое содержание липопротеидов высокой плотности (ЛПВП), высокое содержание липопротеидов низкой плотности (ЛПНП) и триглицеридов (ТГ), нарушенную толерантность к глюкозе, а также инсулинорезистентность (ИР) и гиперинсулинемию (ГИ), лежащих в основе МС. Известно, что при МС, даже без наличия АГ, отмечается субклиническое поражение органов-мишеней, особенно почек – микроальбуминурия (МАУ), снижение скорости клубочковой фильтрации (СКФ), сердца, сосудов. Присоединение АГ значительно усугубляет эти органные нарушения.
Сочетание АГ и ожирения особенно неблагоприятно сказывается на функционировании почек. Так, в международном проспективном исследовании, включавшем 20 828 поликлинических пациентов с АГ, было показано, что при сочетании этих двух заболеваний частота выявления МАУ возрастает примерно в 2 раза, чем в среднем по поликлинической популяции .
Уровень экскреции альбумина с мочой коррелирует не только с показателями индекса массы тела (ИМТ), но и с показателями окружности талии (ОТ) у пациентов с АГ. Даже при избыточной массе тела (ИМТ 25–29,9 кг/м 2) частота МАУ превышает указанный показатель для средней популяции АГ и составляет 58,6%. Для пациентов с ожирением (ИМТ выше 30 кг/м 2) показатель частоты выявляемости МАУ возрастает до 62,1% .
Учитывая большое значение активации РААС в патогенезе АГ у больных с ожирением, становится понятным, почему лекарственные препараты, влияющие на РААС, – ингибиторы ангиотензин-превращающего фермента (ИАПФ), блокаторы рецепторов ангиотензина II (БРА), являются препаратами выбора для лечения АГ у этой группы пациентов. В последние годы появился препарат нового класса – прямой ингибитор ренина (ПИР) – алискирен, с отличным от ИАПФ и БРА влиянием на РААС. ИАПФ блокируют АПФ, БРА блокируют рецепторы к АТ II, а ПИР действуют на ренин, уменьшая плазменную активность ренина. Все эти группы препаратов снижают АД и предотвращают поражение почек, сердца и сосудов.
При назначении ИАПФ и БРА компенсаторно по механизму обратной связи повышается выброс ренина из почек, повышается плазменная активность ренина и порочный каскад запускается вновь. С этим связано ускользание эффекта на ИАПФ. Алискирен является единственным на сегодня селективным ПИР. Алискирен, связываясь с активным центром молекулы ренина, препятствует превращению ангиотензиногена в АТ I. Молекула алискирена является устойчивой, имеет непептидную структуру и высокое сродство к ренину человека. Алискирен действует в начальной точке активации РААС, уменьшая активность ренина плазмы и предотвращая образование АТ I из ангиотензиногена, порочный каскад не запускается и механизм обратной связи не активируется. Повышение плазменной активности ренина является доказанным независимым фактором риска сердечно-сосудистой смертности и осложнений.
В течение последних 15 лет в нескольких исследованиях доказано, что повышенная плазменная активность ренина связана с повышенным риском смертности и заболеваемости у пациентов с АГ, коронарным атеросклерозом и хронической сердечной недостаточностью (ХСН).
Благодаря такому уникальному механизму действия, алискирен уже был выделен в Российских рекомендациях по диагностике и лечению АГ за 2008 год . В 2009 году в новых рекомендациях по диагностике и лечению АГ Европейского общества по артериальной гипертензии нет указания на его применение в той или иной конкретной клинической ситуации . Но в этих же рекомендациях алискирену посвящена целая глава – как новому классу антигипертензивных препаратов. В ней суммируются новые данные, полученные за последние 2 года. Отмечено, что, во-первых, алискирен показал эффективность в снижении систолического АД (САД) и диастолического АД (ДАД) у пациентов с АГ в монотерапии, во-вторых, данный препарат эффективен в комбинации с тиазидными диуретиками, антагонистами кальция, ИАПФ и БРА , в-третьих, недавно появились данные о способности алискирена защищать органы-мишени на этапе субклинических поражений при использовании в комбинации с БРА.
В одном исследовании у пациентов с АГ и СД с протеинурией данная комбинация препаратов привела к большему снижению экскреции белка с мочой, чем при назначении только БРА . В другом же исследовании среди пациентов с АГ и гипертрофией миокарда левого желудочка (ЛЖ) данная комбинация не привела к достоверно большему уменьшению гипертрофии миокарда ЛЖ, чем при назначении только БРА . В третьем исследовании среди пациентов с сердечной недостаточностью данная комбинация достоверно превосходила назначение только блокатора РААС с целью уменьшения концентрации в плазме мозгового натрийуретического пептида , признанного прогностического показателя сердечной недостаточности . Доступные данные оправдывают применение алискирена у пациентов с АГ, особенно в сочетании с другими препаратами. Это также подтверждается хорошей переносимостью алискирена.
Как правило, при уменьшении массы тела происходит снижение уровня АД, и чем больше снижение массы тела, тем более выражена степень снижения АД. Отмечено, что при возрастании ИМТ эффективность антигипертензивной терапии снижается и требует либо увеличения доз препаратов проводимого лечения, либо добавления к схеме лечения дополнительных препаратов. Как показали результаты исследования Bramlage и соавт., с ростом степени ожирения неуклонно увеличивается среднее количество назначаемых препаратов для достижения контроля АД у пациентов с АГ . Так, по данным исследования HYDRA (The Hypertension and Diabetes Risk Screening and Awareness), при нормальном ИМТ монотерапия применяется у 51,1%, а два, три и более препаратов получают 48,9% пациентов, то при ожирении (ИМТ > 40 кг/м 2) два, три и более препаратов получает уже 64,9% пациентов .
Неудовлетворительный контроль АД при ожирении может быть связан с комплексом патофизиологических эффектов, влияющих на почечную функцию и морфологию. Ожирение способствует увеличению реабсорбции натрия в почечных канальцах и уменьшает натрийурез за счет активации РААС и симпатической нервной системы (СНС). Длительно текущее ожирение вызывает значительные структурные нарушения почек и ухудшает функцию нефронов, создавая тем самым предпосылки к дальнейшему прогрессированию АГ. В целом, с увеличением степени ожирения значительно возрастает процент использования таких групп антигипертензивных препаратов как ИАПФ и диуретики, что еще раз подтверждает основные механизмы, поддерживающие высокое АД у пациентов с ожирением: гиперактивация РААС и задержка жидкости.
По данным Prescott и соавт., при анализе эффективности антигипертензивной терапии у пациентов с ожирением (гидрохлортиазид (ГХТЗ), амлодипин/ГХТЗ 10/25 мг, ирбесартан/ГХТЗ 300/25 мг и алискирен/ГХТЗ 300/25 мг) было показано, что с увеличением ИМТ антигипертензивная эффективность терапии, основанной на БРА, антагонистах кальция и диуретике, снижается. В группе пациентов с ожирением 3 степени (ИМТ ≥ 40 мг/м 2) гипотензивный эффект был менее выражен, чем в общей группе пациентов с ожирением 1-2 степени (ИМТ 30–39,9 кг/м 2) .
Напротив, сочетание алискирена с ГХТЗ не только не потеряло эффективность у наиболее тяжелых пациентов, но и в большей степени увеличило антигипертензивный эффект именно у группы с наибольшим ИМТ (> 40 кг/м 2) по сравнению с группой пациентов с меньшей степенью ожирения .
Согласно проведенному анализу (J. Jordan и соавт.) плазменной активности ренина в 4 группах пациентов с ожирением, по сравнению с базальным уровнем плазменная активность ренина значительно увеличивается в группах: монотерапии ГХТЗ (+66,1%), амлодипин/ГХТЗ (+195,6%) и ирбесартан/ГХТЗ (+536,6%). Напротив, в группе терапии алискирен/ГХТЗ плазменная активность ренина достоверно снизилась по сравнению с базальным уровнем (-45%), тем самым нивелируя один из важных независимых факторов СС смертности и СС осложнений .
Эти данные легко объяснить, если принять во внимание механизм действия ПИР – алискирена, который обладает рядом отличий от уже существующих классов. Алискирен действует, связываясь с активным центром молекулы ренина, тем самым предотвращая взаимодействие ренина с ангиотензиногеном и образование АТ I – предшественника АТ II, который способен стимулировать незрелые адипоциты к росту и дифференцировке.
Таким образом, препятствуя превращениям ангиотензиногена, алискирен действует патогенетически и нейтрализует дальнейшую активацию молодых адипоцитов жировой ткани посредством АТ II. Если рассматривать влияние ИАПФ и БРА на РААС, то обращает на себя внимание тот факт, что эти препараты по механизму обратной связи повышают концентрацию и активность ренина и проренина в плазме.
Эффективность алискирена была доказана в ряде сравнительных исследований с ИАПФ. По данным Uresin и соавт., при сравнении двух режимов монотерапии алискиреном 300 мг/сут. и рамиприлом 10 мг/сут. у пациентов с АГ и СД, алискирен обеспечивал достоверно большее снижение АД. Средний ИМТ в исследовании был выше 30 кг/м 2 . Таким образом, в исследовании, где подавляющее большинство пациентов страдали ожирением, алискирен в монотерапии оказался способным снизить АД на 19,7 мм рт. ст. по сравнению с 14,9 мм рт. ст. на проводимой терапии рамиприлом (p
Ожирение является важным фактором риска развития СД типа 2. Около 80% людей с СД типа 2 имеют избыточный вес . У таких пациентов с АГ, ожирением, СД и поражением почек имеют особую значимость достижение контроля уровня АД, метаболическая нейтральность препарата и его способность обеспечить максимальную нефропротекцию.
Так, в исследовании AVOID (Aliskiren in the eValuation of prOteinuria In Diabetes), в котором участвовали Российские клинические центры, включившем 599 пациентов с АГ I–II степени, СД типа 2 и альбуминурией, алискирен показал способность обеспечивать дополнительную нефропротекцию при добавлении к терапии БРА . В этом исследовании к лозартану в дозе 100 мг, назначенному с целью нефропротекции, добавлялись либо алискирен в дозе 300 мг, либо плацебо. Через 6 месяцев терапии в группе комбинированного лечения лозартан + алискирен альбуминурия оказалась на 20% меньше, чем в группе сравнения (лозартан + плацебо) . В группе двойной блокады РААС в 2 раза больше пациентов (24,7%) достигло снижения альбуминурии на 50% по сравнению с группой сравнения (12,5%) (p = 0,0002). При монотерапии у пациентов с АГ и СД алискирен снижал уровень экскреции альбумина с мочой на 48% от исходного уровня, по данным F. Persson и соавт. .
Кроме того, в трех исследованиях, входящих в крупную исследовательскую программу ASPIRE HIGHER («Стремление ввысь») по оценке возможностей алискирена в защите органов-мишеней в различных ситуациях с очень высоким риском развития потенциально фатальных осложнений (гипертрофия ЛЖ, СД типа 2, ХСН), были продемонстрированы его дополнительные кардиопротективные и нефропротективные свойства. В исследовании AVOID присоединение алискирена к лозартану обеспечивало достоверное дополнительное по сравнению с плацебо уменьшение соотношения альбумин/креатинин мочи у пациентов с АГ и диабетической нефропатией .
В исследовании ALOFT (The Aliskiren Observation Of Heart Failure Treatment Study) показано, что добавление препарата к стандартной терапии у пациентов с АГ и ХСН приводило к достоверно большему снижению уровня мозгового натрийуретического пептида в плазме крови (маркер тяжести течения ХСН) .
Исследование ALLAY (Aliskiren in Left Ventricular Hypertrophy) продемонстрировало способность алискирена уменьшать гипертрофию миокарда ЛЖ у пациентов с АГ, сопоставимую с лозартаном . В информационном письме – обращении в регионы рабочей группы экспертов Российского медицинского общества артериальной гипертонии во главе с профессором И.Е. Чазовой указано, что потенциально предпочтительными клиническими ситуациями для назначения алискирена являются:
- АГ и абдоминальное ожирение;
- АГ и СД типа 2;
- АГ и МС;
- АГ II–III степени в составе комбинированной терапии;
- АГ и ХСН;
- АГ и МАУ/протеинурия;
- резистентная АГ.
В отделе системных гипертензий Института клинической кардиологии им А.Л. Мясникова проведено исследование, посвященное изучению эффективности ПИР алискирена у больных с МС, целью которого явилась оценка влияния алискирена на уровень АД, показатели углеводного, липидного обмена, микроальбуминурии и жесткость сосудистой стенки.
Материалы и методы
В исследовании приняли участие 33 больных с МС. Все включенные в исследование пациенты имели признаки абдоминального ожирения и ИМТ более 25 кг/м². Возраст пациентов варьировал в пределах от 27 до 59 лет, в среднем составил 41,2 ± 0,9 лет. По половому признаку пациенты распределились в соотношении 16 мужчин и 17 женщин. Все пациенты имели АГ I–II степени, длительность АГ составляла от 6 месяцев до 15 лет, в среднем 4,8 ± 3,2 года.
Дополнительные критерии: артериальная гипертония (АД ≥ 130/85 мм рт. ст.), повышение уровня триглицеридов (≥ 1,7 ммоль/л), снижение уровня ХС ЛПВП (3,0 ммоль/л, гипергликемия натощак, нарушение толерантности к глюкозе. Наличие у пациента центрального ожирения и двух из дополнительных критериев является основанием для диагностирования у него метаболического синдрома.
Критериями исключения были тяжелые сердечно-сосудистые заболевания, включающие артериальную гипертонию III степени, острый инфаркт миокарда, стенокардию III–IV ФК, нестабильную стенокардию, сердечную недостаточность, острое нарушение мозгового крово-обращения, клинически значимые изменения ЭКГ, требующие немедленной терапии; вторичные АГ: реноваскулярную, эндокринную; хроническую почечную недостаточность; тяжелые нарушения функции печени (превышение уровня трансаминаз в 2 раза и более нормы); беременность и период лактации.
Всем пациентам, включенным в исследование, был назначен алискирен в дозе 150–300 мг/сут. До начала исследования 70% пациентов уже принимали антигипертензивную терапию, однако целевого уровня АД не достигли. Больным, которые уже принимали ИАПФ, БРА или антигипертензивные препараты других классов в виде монотерапии в средних терапевтических дозах, но, тем не менее, не достигшим целевого уровня АД, предшествующая терапия была заменена на алискирен в стартовой дозе 150 мг. Если дозы указанных групп препаратов были максимальными, то стартовая доза алискирена составила
300 мг/сут, при необходимости для достижения целевых значений АД к терапии алискиреном добавляли гипотиазид в дозе 12,5 мг.
До и после терапии использовались следующие методы исследования: антропометрические – окружность талии (показа-тель абдоминального ожирения) определяли при помощи сантиметровой ленты, накладываемой циркулярно под краем реберной дуги. ИМТ рассчитывался по формуле Кетле: ИМТ = масса тела (кг) / рост (м), возведенный в квадрат. Показатели – холестерин, триглицериды – определяли в пробах венозной крови, взятой натощак, то есть не ранее чем через 12 ч после последнего приема пищи, при помощи ферментативного колориметрического метода с использованием наборов фирмы DIASYS (Германия) на биохимическом автоанализаторе EXPRESS PLUS (CHIRON/Diagnostics, Великобритания). Содержание глюкозы в плазме крови определяли глюкозооксидазным методом с использованием набора Glucose GOD-PAP (Roche) на автоанализаторе EXPREES PLUS (CHIRON/Diagnostics, Великобритания). Результаты выражали в ммоль/л. Проведение перорального теста толерантности к глюкозе (ПТТГ) начинали не позднее 10 ч утра. После забора пробы венозной крови для определения уровня глюкозы натощак, пациент принимал внутрь 75 г дегидратированной глюкозы, разведенной в 200 мл воды, после чего через 2 ч осуществляли следующий забор крови для определения постпрандиального уровня глюкозы. Микроальбуминурию определяли методом иммунотурбидиметрического анализа. За норму принимали концентрацию альбумина в моче менее 20 мг/л в ночной порции мочи. Регистрация ЭКГ в 12-ти отведениях проводилась по стандартной методике.
Состояние сосудистой стенки оценивали плече-лодыжечным методом объемной сфигмографии с помощью прибора VaSera-1000 (Fucuda Denshi, Япония) по следующим показателям:
- R/L-PWV – скорости пульсовой волны (СПВ) по артериям преимущественно эластического типа справа и слева;
- CAVI1/L-CAVI1 – сердечно-лодыжечному сосудистому индексу справа и слева. Это новый показатель, отражающий истинную жесткость сосудистой стенки. Он позволяет исключить влияние уровня АД на артериальную ригидность. CAVI вычисляется путем регистрации пульсовых волн в двух точках и измерением систолического и диастолического АД (Ps, Pd): CAVI = 1/k 2 (ln x Ps/Pd) PWV" 2 ;
- R-АI – индексу прироста (аугментации), характеризующему величину отраженной волны. Он вычислялся по формуле: R-АI = Р1/Р2, где Р1 – давление на пике ударной волны и Р2 – давление на пике отраженной волны.
- При обработке результатов использовался пакет прикладных программ Statistica 6.0 (StatSoft Inc., США). При нормальном распределении для анализа применяли параметрический критерий t Стьюдента. Результаты представлены в виде М ± SD. Для каждого признака (из числа включенных в анализ) проводили попарное сравнение заданных групп пациентов (реализаций), с выявлением достоверных различий между ними.
Результаты
В результате лечения алискиреном достоверно снизились практически все исходно повышенные показатели суточного профиля АД. Целевого уровня АД (как САД, так и ДАД) достигли 80% пациентов. В среднем днем САД снизилось с 137,38 ± 2,3 до 126,57 ± 1,9 мм рт. ст. (р ≤ 0,01), ДАД с 84,90 ± 1,99 до 78,14 ± 1,25 мм рт. ст. (р ≤ 0,05) (рис. 1).
На фоне терапии алискиреном произошло значительное снижение индекса времени (ИВ) САД с 53,07 ± 5,91 до 21,28 ± 4,71% (р ≤ 0,001) и ИВ ДАД с 47,70 ± 6,54 до 20,04 ± 4,59% (р ≤ 0,001), что свидетельствует о высокой антигипертензивной эффективности препарата.
У пациентов, принимающих алискирен, через 6 месяцев вес тела снизился в среднем с 95,18 ± 4,84 до 93,03 ± 4,61 кг, однако эти изменения были недостоверными. ИМТ и ОТ существенно не менялись.
В результате терапии алискиреном уровень глюкозы натощак не менялся, однако отмечено достоверное снижение постпрандиального уровня глюкозы с 7,22 ± 0,36 до 6,20 ± 0,22 ммоль/л (р ≤ 0,05) (рис. 2). Показатели липидного обмена достоверно не менялись. В целом по группе значимого снижения микроальбуминурии не произошло, однако, при более тщательном анализе, в группе пациентов с исходно высоким уровнем микроальбуминурии, отмечено достоверное снижение уровня микроальбумина мочи с 70,2 ± 21,7 до 41,3 ± 13,6 мг/л (р ≤ 0,05) (рис. 3).
Еще одной задачей нашего исследования была оценка влияния терапии алискиреном на состояние магистральных сосудов. По данным объемной сфигмографии отмечено уменьшение ригидности артерий. СПВ, которая исходно была выше нормальных значений, достоверно снизилась с 14,21 ± 0,45 до 12,98 ± 0,23 м/с (р ≤ 0,05) (рис. 4), т.е. достигла нормы.
Индексы CAVI имели тенденцию к снижению, однако достоверной динамики этих показателей получено не было. Помимо СПВ и СAVI, оценивался индекс R-AI, дающий представление о системной артериальной эластичности, геометрии и тонусе артериального дерева. Нами зарегистрировано достоверное снижение этого параметра c 1,13 ± 0,04 до 1,01 ± 0,01 (р ≤ 0,05), что свидетельствует об улучшении структурно-функциональных свойств сосудистой стенки.
На фоне назначения алискирена не было существенной динамики показателей креатинина, АСТ и АЛТ. Побочных эффектов на фоне его приема не наблюдалось, абсолютное большинство больных отметили хорошую переносимость препарата и отсутствие нежелательных явлений при его назначении.
Выводы
- Терапия алискиреном сопровождалась хорошим антигипертензивным эффектом со снижением как систолического, так и диастолического АД до целевых значений у 80% пациентов с АГ и МС. Лечение алискиреном у больных с АГ и МС сопровождалось улучшением показателей углеводного обмена: отмечалось достоверное снижение постпрандиального уровня глюкозы.
- Терапия алискиреном не оказала влияния на показатели липидного обмена у больных АГ и МС.
- У пациентов с МС и АГ, а также исходно высоким уровнем микроальбуминурии в результате терапии алискиреном отмечено достоверное снижение микроальбумина мочи.
- На фоне лечения алискиреном зарегистрировано снижение ригидности магистральных артерий и улучшение структурно-функциональных свойств сосудистой стенки, отмечено достоверное снижение скорости пульсовой волны и индекса аугментации R-AI.
- Терапия алискиреном сопровождалась хорошим профилем переносимости и отсутствием нежелательных явлений при его применении.
Таким образом, прямое ингибирование ренина с помощью алискирена у больных с МС и АГ продемонстрировало высокую антигипертензивную эффективность с хорошим профилем переносимости и безопасности. Терапия алискиреном сопровождается достоверным улучшением основных показателей суточного профиля АД, снижением постпрандиального уровня глюкозы, уменьшением исходно повышенного уровня микроальбумина в моче, а также снижением ригидности магистральных артерий уже в первые 6 месяцев лечения.
История изучения ренин-ангиотензинальдостероновой системы (РААС), оказавшаяся наиболее успешной с точки зрения разработки подходов к фармакологической модуляции ее активности, позволяющих продлить жизнь пациентов с сердечно-сосудистыми и почечными заболеваниями, началась 110 лет назад. Когда был идентифицирован ренин – первый компонент. В дальнейшем в экспериментальных и клинических исследованиях удалось уточнить физиологическую роль ренина и его значение в регуляции активности РААС при разных патологических состояниях, ставшие основой для разработки высокоэффективной терапевтической стратегии – прямых ингибиторов ренина.
В настоящее время первый прямой ингибитор ренина Расилез (алискирен) назначение обосновано даже в тех ситуациях, когда другие блокаторы РААС – иАПФ и БРА не показаны или применение их затруднено в связи с развитием нежелательных явлений.
Еще одним обстоятельством, позволяющим рассчитывать на дополнительные по сравнению с другими блокаторами РААС возможности прямых ингибиторов ренина в защите органов-мишеней АГ, является то, что при применении препаратов, блокирующих РААС на других уровнях, по закону отрицательной обратной связи происходит как увеличение концентрации проренина, так и увеличение плазменной активности ренина. Именно этим обстоятельством отменяется нередко отмечаемое снижение эффективности иАПФ, в том числе и с точки зрения их возможностей в снижении повышенной АД. Еще в начале 1990-х годов, когда многие органопротективные эффекты иАПФ не были установлены так достоверно, как сегодня, было показано, что по мере увеличения их дозы достоверно нарастают плазменная активность ренина и плазменная концентрация ангиотензина. Наряду с иаПФ и БРА, провоцировать подъем плазменной активности ренина могут также тиазидовые и петлевые диуретики.
Первым прямым ингибитором ренина, эффективность которого была подтверждена в контролируемых клинических исследованиях III фазы, обладающим достаточной продолжительностью действия и снижающим повышенное АД даже в режиме монотерапии, стал алискирен, и его назначение сегодня можно рассматривать как инновационный подход к лечению АГ. Были проведены сопоставления его влияния на плазменную концентрацию и активность отдельных составляющих РААС с иАПФ и БРА. Оказалось, что алискирен и эналаприл почти в равной степени уменьшают плазменную концентрацию ангиотензина II, но в отличие от алискирена прием эналаприла приводил к более чем 15-кратному росту активности ренина в плазме крови. Способность алискирена предупреждать негативные изменения в балансе активности компонентов РААС была также продемонстрирована при его сопоставлении с БРА.
Объединенный анализ клинических исследования, суммарно включавших 8481 больного, получавших монотерапию алискиреном или плацебо, показал, что однократный прием алискирена в дозе 150 мг/сут. или 300 мг/сут. обуславливал снижение САД на 12,5 и 15,2 мм рт.ст. соответственно в сравнении со снижением на 5,9 мм рт.ст., плацебо (Р<0,0001). Диастолическое АД снижалось на 10,1 и 11,8 мм рт.ст. соответственно (в группе, принимавшей плацебо – на 6,2 мм рт.ст.; Р < 0,0001). Различий в антигипертензивном эффекте алискирена у мужчин и женщин, а также у лиц старше и моложе 65 лет не выявлено.
В 2009 году опубликованы результаты многоцентрового контролируемого клинического исследования, в котором у 1124 больных АГ сравнивали эффективность алискирена и гидрохлортиазида. При необходимости к этим препаратам присоединяли амлодипин. Уже к завершению периода монотерапии стало ясным, что алискирен приводит к более выраженному снижению АД, чем гидрохлортиазиду (-17,4/-12,2 мм рт.ст. против -14,7/-10,3 мм рт.ст.; Р < 0,001)
Ренин-ангиотензин-альдостероновая система (РААС ) регулирует АД, а также натриевый и водный гомеостаз.
Ренин синтезируется специализированными гладкомышечными клетками в стенке приносящей артериолы почечного клубочка (юкстагломерулярный аппарат). Выброс ренина может быть обусловлен падением почечного перфузионного давления и симпатической активацией p-адренорецепторов в юкстагломерулярных клетках.
Как только ренин попадает в кровь, он расщепляет синтезируемый в печени ангиотензиноген до декапептида ангиотензина I. АПФ, в свою очередь, превращает ангиотензин II в биологически активный ангиотензин II.
АПФ , циркулирующий в плазме, локализуется на поверхности эндотелиальных клеток. Это неспецифическая пептидаза, способная отщеплять С-терминальные дипептиды от разнообразных пептидов (дипептидилкарбоксипептидаза). Таким образом, АПФ помогает инактивировать кинины, например брадикинин.
Ангиотензин II
может активировать два разных рецептора (АТ 1 и АТ 2), связанных с G-белками. Наиболее значимое действие, которое ангиотензин II оказывает на сердечно-сосудистую систему, опосредовано АТ 1 -рецепторами. Ангиотензин II повышает АД различными способами:
1) сужением сосудов как артериального, так и венозного русла;
2) стимуляцией секреции альдостерона, приводящей к увеличению почечной реабсорбции NaCl и воды, а следовательно, и к увеличению ОЦК;
3) центральным повышением тонуса симпатической нервной системы, а на периферии - усиленным выделением и действием норадреналина. Длительное повышение уровня ангиотензина II может привести к гипертрофии мышечных клеток сердца и артерий и увеличению количества соединительной ткани (фиброз).
а) Ингибиторы АПФ , такие как каптоприл и эналаприл, занимают активный центр этого фермента, конкурентно ингибируя расщепление ангиотензина I. Эти препараты применяются при гипертензии и хронической сердечной недостаточности. Снижение повышенного АД обусловлено главным образом уменьшением образования ангиотензина II. Также свой вклад может вносить ослабление распада кининов, оказывающих сосудорасширяющее действие.
При застойной сердечной недостаточности после применения повышается минутный объем сердца, т. к. вследствие падения периферического сопротивления уменьшается постнагрузка желудочков. Уменьшается венозный застой (предна-грузка), снижается секреция альдостерона и тонус венозных емкостных сосудов.
Побочные эффекты . Если активация РААС обусловлена потерей электролитов и воды (в результате лечения мочегонными препаратами, сердечной недостаточности или стеноза почечной артерии), применение ингибиторов АПФ вначале может вызывать чрезмерное падение АД. Достаточно часто наблюдается такой побочный эффект, как сухой кашель (10%), причиной которого может быть снижение инактивации кининов в слизистой оболочке бронхов.
Комбинация ингибиторов АПФ с калийсберегающими диуретиками может приводить к гиперкалиемии. В большинстве случаев ингибиторы АПФ хорошо переносятся и дают хороший терапевтический эффект.
К новым аналогам данных препаратов относятся лизиноприл, рамиприл.квинаприл, фозиноприл и беназеприл.
б) Антагонисты АТ 1 -рецепторов ангиотензина II («сартаны »). Блокада АТ 1 -рецепторов антагонистами подавляет активность ангиотензина II. Первым препаратом в группе «сартанов» был лозартан, вскоре были разработаны аналоги. К ним относятся кандесартан, эпросартан, олменсартан, телмесартан и валсартан. Основные (гипотензивные) эффекты и побочное действие такие же, как у ингибиторов АПФ. Однако «сартаны» не вызывают сухой кашель, т. к. не ингибируют распад кининов.
в) Ингибитор ренина . С 2007 г. на рынке появился прямой ингибитор ренина (алискирен), который можно использовать для лечения гипертензии. Этот препарат плохо всасывается после приема внутрь (биодоступность 3%) и очень медленно выводится (период полураспада 40 ч). Спектр его действия аналогичен антагонистам АТ 1 -рецепторов.








 Внедрение и использование УМК «Изучаем русский язык» в двуязычной образовательной среде
Внедрение и использование УМК «Изучаем русский язык» в двуязычной образовательной среде Система образования в индии как фундамент знаний и жизни
Система образования в индии как фундамент знаний и жизни Роман Вишневский – трейдер и владелец брокерской компании
Роман Вишневский – трейдер и владелец брокерской компании Николай Кольцов – биолог из будущего
Николай Кольцов – биолог из будущего